MED TRUST - pålitlig kvalitet
Kvalitetsstyrning
Beprövad kvalitet.
Efterlevnaden av de mest strikta lagkraven för våra hälsovårdsprodukter och tjänster utgör grunden för vårt arbete.
Det bästa beviset på det krävande kvalitetsledningssystemet ”MED TRUST” är åren av certifiering enligt EN ISO 13485:2016 och CE-certifikaten för våra medicintekniska produkter enligt EU-direktiven 93/42/EEC (MDD) och In Vitro Diagnostics 98/ 79/EG (IVDD) av TÜV Rheinland.
EU Medical Device Regulation 2017/745 (MDR) och In Vitro Diagnostics Regulation 2017/746 (IVDR) ställer mycket högre standarder för bland annat den tekniska dokumentationen, kliniska data, omfattande rapporterings- och anmälningskrav för att kunna garantera en hög nivå av prestanda, säkerhet och hälsoskydd.
Vårt dedikerade MED TRUST kvalitetslednings- och regulatoriska (Q&R) team arbetar kontinuerligt med den tekniska dokumentationen för våra medicinska produkter, vilket bevisar att Wellion´s produkter helt uppfyller de ökade kraven för CE-överensstämmelse enligt MDR och IVDR.
Registrerade Wellion-produkter kommer att säljas och förbli på marknaden i enlighet med bestämmelserna fram till slutet av giltighetstiden för CE-certifikaten (MDD/IVDD), även i övergångsfasen (MDR och IVDR "Grace Period").

MED TRUST uppfyller samvetsgrant sin omsorgsplikt enligt MDR/IVDR och får därigenom - framför allt - nöjda kunder vars förtroende för oss fortsätter att växa!
MED TRUST - Fakta och siffror om MDR/IVDR
Ikraftträdande av EU:s förordningar om medicintekniska produkter:
MDR: 26.05.2021
IVDR: 26.05.2022
- EUDAMED Registration (SRN):
Single Registration Number (SRN)
Introduktion av Unique Device Identification (UDI) i form av en datamatrix (unik produktnyckel)
Utnämning av den ansvariga personen (PRRC)
Komplex marknadsövervakning (inklusive PMS, PSUR, vaksamhet, EUDAMED-meddelande)
Anpassning av kvalitetsledningssystemet:
Inklusive riskhantering, eftermarknadsövervakning, marknadsövervakning, vaksamhet samt hantering av reklamationer, spårbarhet (UDI) och förändring.Utrymme för certifieringsprocess med det anmälda organet säkrat
MED TRUST som tillverkare
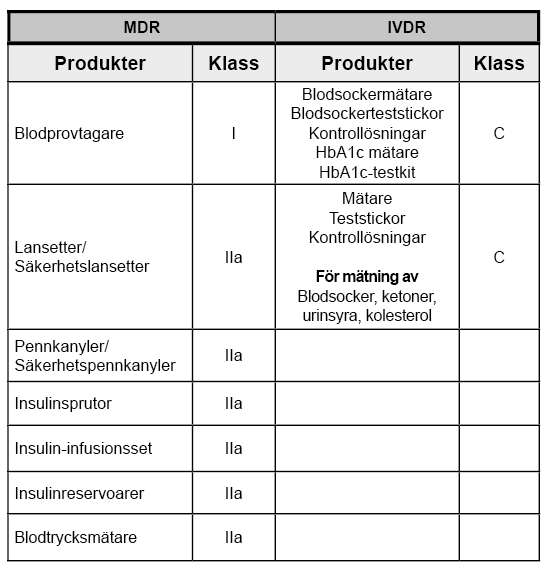
Portfölj av Wellion-produkter:
MED TRUST som importör
Portfölj av Wellion-produkter med eget märke:Blodtrycksmätare
Nebulisator – MESH Nebulisator
Termometer
Pulsoximeter
Engångsspruta med lågt deadspace
Kanyler / Säkerhetskanyler
SARS-CoV-2 antigentest
SARS-CoV-2 antikroppstest
Sensor (CGMS)
Insulinpumpsystem
https://www.medtrust.se/produkter/wellion-produkter-humanvaard/
Vanliga frågor om MDR / IVDR på MED TRUST:
Vad är syftet med de nya EU-förordningarna MDR och IVDR?
Bakgrunden till MDR eller IVDR är kravet på högre säkerhet för produkter samt deras eftermarknads-uppföljning. Det bör leda till bättre skydd av folkhälsan och patientsäkerheten, inklusive ökad transparens och spårbarhet.
Vilka MED TRUST-produkter berörs?
All medicinteknisk utrustning och in vitro-diagnostik.
Vad är bedömningen av överensstämmelse?
Medicintekniska produkter är CE-märkta och ska ha genomgått ett så kallat förfarande för bedömning av överensstämmelse, som i slutändan ska utföras inte bara av tillverkaren utan även av det "så kallade" Notified Body (anmält organ). Den positiva slutsatsen av ett sådant förfarande är produkterna bekräftas genom att det anmälda organet utfärdar ett EG-certifikat.
Vad är en försäkran om överensstämmelse?
Försäkran om överensstämmelse är ett dokument genom vilket en tillverkare av en produkt på eget ansvar och på ett juridiskt bindande sätt (tillverkarens försäkran om överensstämmelse) deklarerar att dess produkt uppfyller kraven i de relevanta EU-direktiven.
Försäkran om överensstämmelse för de registrerade produkterna görs tillgängliga av MED TRUST för myndigheter och aktuella inspektioner, enligt krav enligt MDR eller IVDR, artikel 14 "distributörers skyldigheter".
Hur kan en kund (återförsäljare, apotek, sjukhus, partners, etc.) till MED TRUST kontrollera produkternas överensstämmelse?
CE-märkningen syns tydligt på MED TRUST`s produktförpackning.
https://www.certipedia.com/companies/573410/system_certificates?locale=de
Vad betyder övergångsperioder för MDR och IVDR?
Om CE-certifikat har utfärdats i enlighet med direktiven 90/385/EEG och 93/42/EEG förblir de giltiga till slutet av den period som anges i certifikatet. Förutsatt att det inte sker några väsentliga förändringar, t.ex. organisatoriska förändringar, förändringar som inte har samband med utformningen och avsett syfte. Parallella certifieringar är möjliga fram till den 26 maj 2020. De sista MDD/IVDD-certifikaten löper ut den 26 maj 2024 respektive 26 maj 2025 och produkterna kan säljas i ytterligare ett år vardera.
Vad kostar MDR/IVDR på MED TRUST?
MED TRUST arbetar kontinuerligt med att skapa resurser för att säkerställa att EU:s regelverk implementeras i tid. Investeringar i miljonbelopp görs allt mer, med de främsta kostnadsdrivande faktorerna skapandet av teknisk dokumentation på högre nivå, ökade krav på övervakning efter marknaden, kommunikation och revision av outsourcade processer, UDI-märkning och lagerlogistik, bland annat.
Har MED TRUST ett kvalitetsledningssystem som ständigt övervakas?
Ja, MED TRUST granskas årligen av TÜV Rheinland som dess anmälda organ. Vidare genomförs internrevisioner enligt EN ISO 13485 inom flera områden, vilket säkerställer vidareutvecklingen av kvalitetsledningssystemet enligt de nya EU-kraven.
Uppfyller MED TRUST kraven i MDR/IVDR?
Den tekniska dokumentationen för produkterna har redan utarbetats och uppdateras kontinuerligt i enlighet med de senaste riktlinjerna (MDCG) och kraven från det anmälda organet. Den gradvisa övergången av produkterna kommer att ske fram till CE-certifikatens maximala löptid 2024 resp. 2025.
